
PROCYSBI® är indicerat för behandling av verifierad nefropatisk cystinos. Cysteamin minskar cystinackumulering i vissa celler (t.ex. leukocyter, muskel- och leverceller) hos patienter med nefropatisk cystinos och vid tidigt insatt behandling fördröjer det utvecklingen av njursvikt.1
Cystinkontroll med dosering två gånger dagligen1,2
PROCYSBI är baserad på en kornformad, enterodragerad form av cysteaminbitartrat med fördröjd frisättning, där de mikrosfäriserade kornen har inkapslats ytterligare i en hård gelatinkapsel för att möjliggöra oral administrering var tolfte timme.3
Differentierad tarmabsorption möjliggör långvarig frisättning av cysteamin, vilket ger en ökad biotillgänglighet
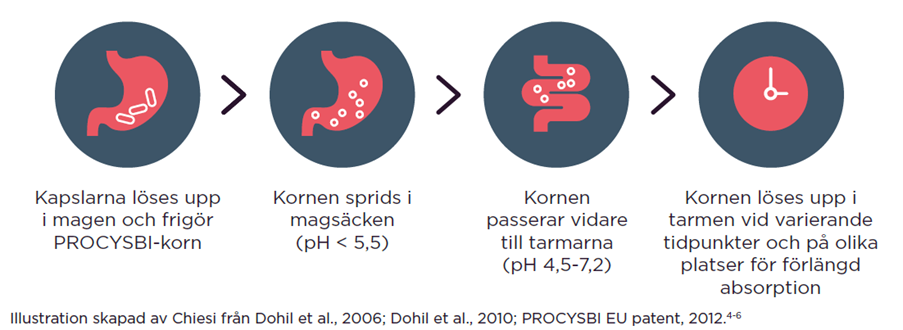
- En långsammare absorption av cysteamin på grund av en sammansättning som ger fördröjd frisättning av PROCYSBI driver farmakokinetiken och leder till en liknande topp av cysteaminnivåerna som åstadkoms med cysteamin med omedelbar frisättning, men med en förlängd platåtid.3
- PROCYSBI passerar förbi magsäcken, vilket resulterar i långvarig absorption i tunntarmen7
- PROCYSBI ger 12 timmars cystinkontroll, vilket möjliggör dosering två gånger dagligen1,3
Cysteaminbehandling ska sättas in snabbt så snart diagnosen är bekräftad (dvs. förhöjt WBC-cystin) för att uppnå maximal nytta.1
PROCYSBI finns i antingen 25 mg eller 75 mg hårda enterokapslar innehållande cysteamin.1
Klicka på produktnamn för fullständig förskrivarinformation:
Procysbi, Enterokapsel, hård 25 mg
Procysbi, Enterokapsel, hård 75 mg
Referenser:
- PROCYSBI produktresumé, www.fass.se.
- Langman CB, Greenbaum LA, Grimm P, et al. Quality of life is improved and kidney function preserved in patients with nephropathic cystinosis treated for 2 years with delayed-release cysteamine bitartrate. J Pediatr. 2014;165(3):528-33.e1. doi:10.1016/j.jpeds.2014.05.013
- Langman CB, Greenbaum LA, Sarwal M, et al. A randomized controlled crossover trial with delayed-release cysteamine bitartrate in nephropathic cystinosis: effectiveness on white blood cell cystine levels and comparison of safety [published correction appears in Clin J Am Soc Nephrol. 2013 Mar 7;8(3):468]. Clin J Am Soc Nephrol. 2012;7(7):1112-1120. doi:10.2215/CJN.12321211
- Dohil R, Fidler M, Gangoiti JA, Kaskel F, Schneider JA, Barshop BA. Twice-daily cysteamine bitartrate therapy for children with cystinosis. J Pediatr. 2010;156(1):71-75.e753. doi:10.1016/j.jpeds.2009.07.016
- Dohil R, Rioux P. Pharmacokinetic Studies of Cysteamine Bitartrate Delayed-Release. Clin Pharmacol Drug Dev. 2013;2(2):178-185. doi:10.1002/cpdd.12
- European patent office, PROCYSBI patent EU EP1919458A2. 2012. https://patents.google.com/patent/EP1919458A2/zh: (Accessed 25.10.2024)
- Medic G, van der Weijden M, Karabis A, Hemels M. A systematic literature review of cysteamine bitartrate in the treatment of nephropathic cystinosis. Curr Med Res Opin. 2017;33(11):2065-2076. doi:10.1080/03007995.2017.1354288
Förkortad produktinformation
PROCYSBI (cysteamin) 25 och 75 mg enterokapslar hårda. Rx, EF. Farmakoterapeutisk grupp: Övriga medel för matsmältning och ämnesomsättning, ATC-kod: A16AA04. Indikation: Behandling av verifierad nefropatisk cystinos. Cysteamin minskar cystinackumulering i vissa celler (t.ex. leukocyter, muskel- och leverceller) hos patienter med nefropatisk cystinos och vid tidigt insatt behandling fördröjer det utvecklingen av njursvikt. Dosering: Cysteaminbehandling bör sättas in snabbt så snart diagnosen är bekräftad för att uppnå maximal nytta. Behandling med PROCYSBI ska inledas under övervakning av läkare med erfarenhet av behandling av cystinos. Kontraindikationer: Överkänslighet mot den aktiva substansen eller penicillamin. Amning. Varningar och försiktighet: Oralt cysteamin förebygger inte inlagring av cystinkristaller i ögonen. I de fall där cysteaminögondroppar används för detta ändamål bör denna användning fortsätta. Odelade PROCYSBI-kapslar bör inte ges till barn under cirka 6 års ålder på grund av aspirationsrisk. Det har kommit rapporter om allvarliga hudlesioner hos patienter som behandlats med höga doser av cysteaminbitartrat och andra cysteaminsalter. Läkare bör därför regelbundet kontrollera hud och skelett och om några avvikelser uppstår, bör dosen av cysteamin sänkas eller stoppas. Sår och blödning i magtarmkanalen har rapporterats hos patienter som får cysteaminbitartrat för omedelbar frisättning. Läkare bör vara vaksamma på tecken på sårbildning och blödning samt informera patienter och/eller vårdare om tecknen och symtomen på allvarlig toxicitet i magtarmkanalen och vad som ska göras om sådana symtom uppkommer. Benign intrakraniell hypertension och/eller papillödem har rapporterats under behandling med cysteaminbitartrat. Regelbunden ögonundersökning behövs för att hitta detta tidigt och behandling bör sättas in i god tid för att förhindra synnedsättning. Graviditet: Negativt graviditetstest ska bekräftas innan behandlingen påbörjas. Inte användas under graviditet, speciellt inte under första trimestern, om det inte är absolut nödvändigt (se avsnitt 4.4). Lokal kontakt: Chiesi Pharma AB, Klara Norra kyrkogata 34, 5 tr, 111 22 Stockholm, Tel: +46 8 753 35 20. För fullständig förskrivarinformation, se www.fass.se. Senaste datum för översyn av produktresumén: Maj2023.